Perbedaan Reaksi Oksidasi Dan Reduksi Hisham Id My XXX Hot Girl
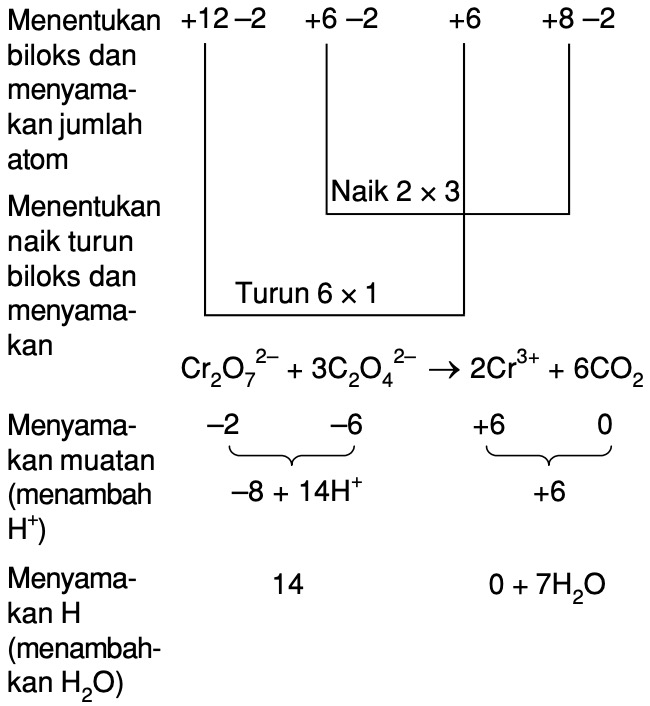
Halo keren padahal kali ini kita diminta untuk menentukan reaksi oksidasi dari CR nah disini adalah soal ya harusnya CR 2 + menjadi cro4 2 min melepaskan elektron sebanyak Berapa mol jika cl2 + nya 1 mol berarti kita harus setarakan setengah reaksi ini menggunakan penyetaraan persamaan redoks setengah reaksi dan di sini sudah menjadi setengah yaitu hanya reaksi oksidasi berarti langkah 1 dan.

Jelaskan Konsep Reaksi Oksidasi Dan Reduksi Menurut Perubahan Bilangan Oksidasi Tulisan
Halo governance dalam hal ini kita diminta untuk menjelaskan atau menghitung berapakah elektron yang dilepaskan dari reaksi oksidasi 1 mol CR 3 + menjadi cro4 2 minus maka disini reaksinya adalah sebagai berikut yaitu CR 3 + menjadi cro4 2 minus kita setarakan terlebih dahulu reaksi oksidasi tersebut nah disini kita terlebih dahulu menyetarakan jumlah atom o dengan penambahan H2O kemudian kita.

Metode PBO, Penyetaraan 24 CrI3 + Cl2 → CrO42 + IO4 + Cl (Asam) YouTube
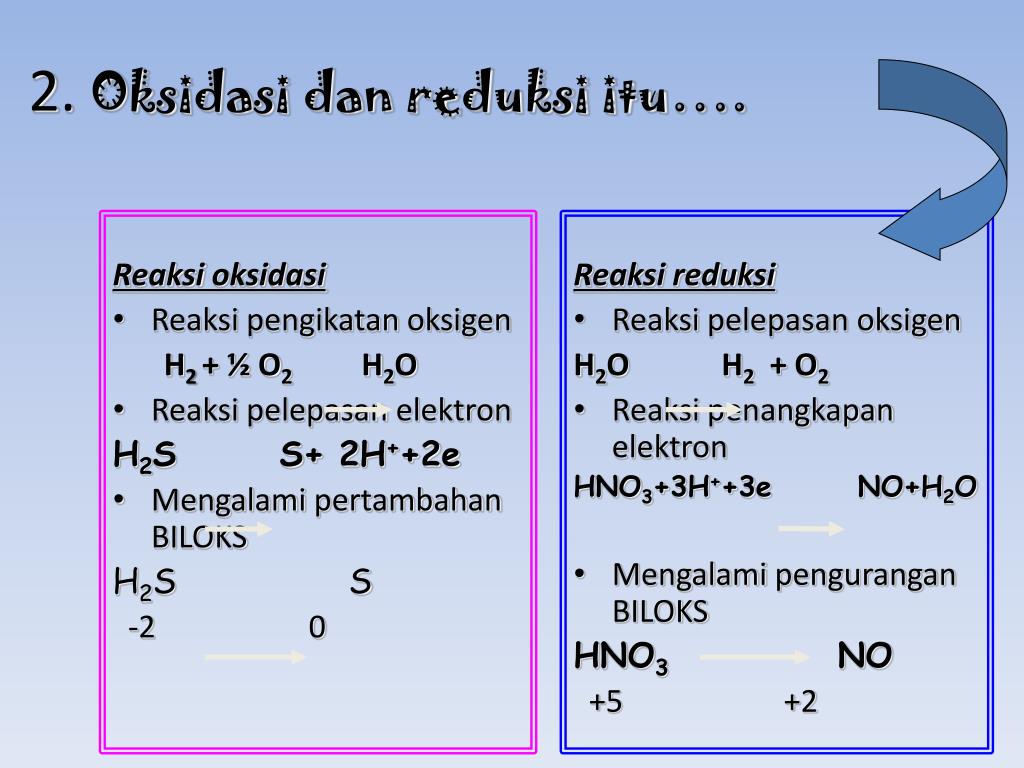
A. 1 D. 4 B. 2 E. 5 C. 3 @2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 20 Modul Kimia Kelas XII KD 3.3 Kunci Jawaban dan Pembahasan Soal Latihan No Kunci Pembahasan 1 E (1)MnO4- → MnO2 (Terjadi pelepasan oksigen → reduksi) (2) Zn → ZnO2- (Terjadi pengikatan oksigen → oksidasi) +4 -4 +6 -8 (3) 2CO2 → C2O42.

Menghitung Bilangan Oksidasi Unsur
Oksidasi 1 mol Cr^3+ menjadi CrO4^2- melepaskan elektron seb. kimia kimia fisik dan analisis reaksi redoks dan sel elektrokimia penyetaraan persamaan reaksi redoks Copy Link
.png)
Reaksi Redoks Pengertian, Ciri, Konsep, dan Menentukan BIlangan Oksidasi
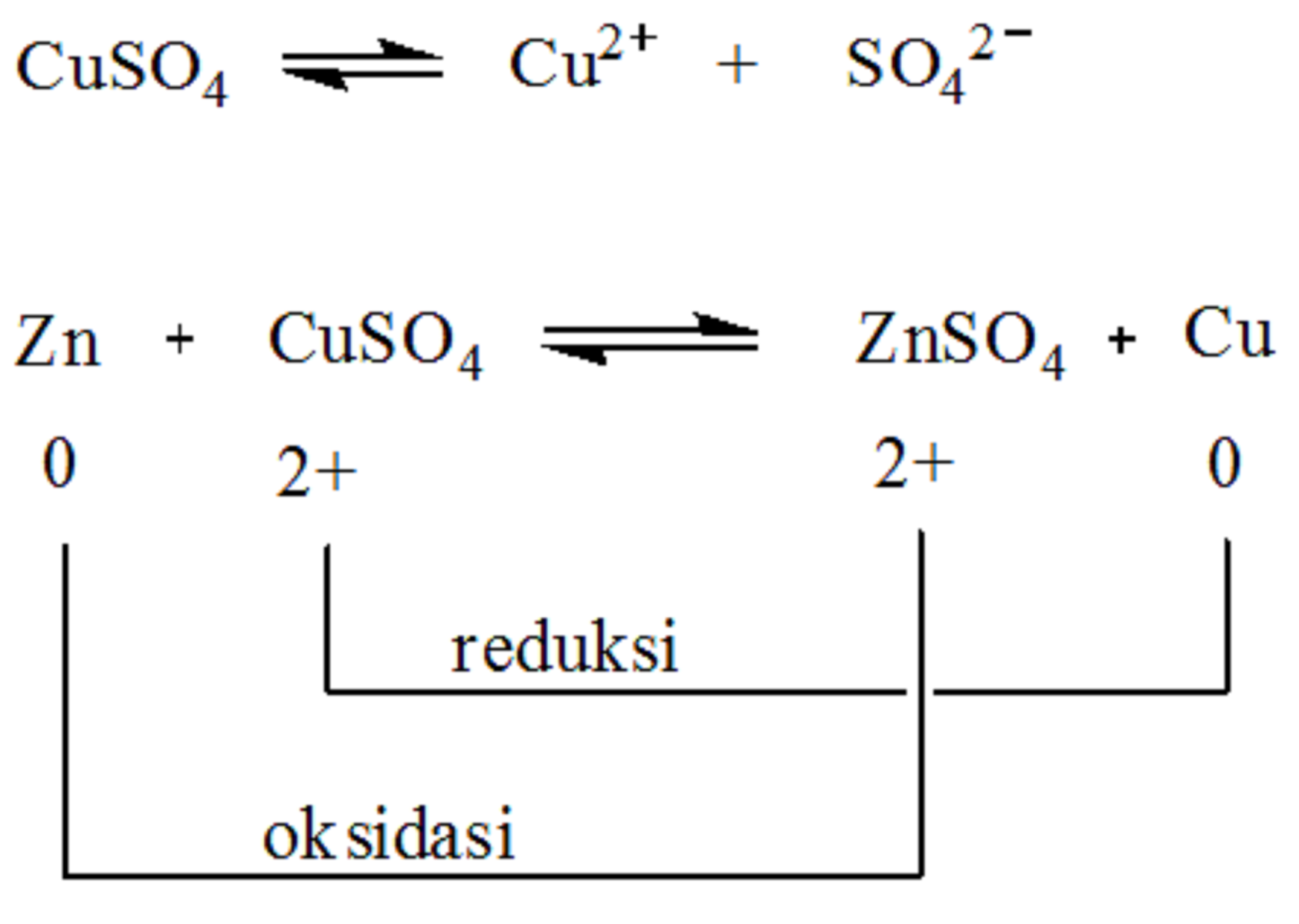
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.
PERCOBAAN VIII REAKSI REDOKS Kimia Dasar II Najih Web Id 30240 Hot Sex Picture
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Oksidasi 1 mol Cr^3+ men.

Metode PBO, Penyetaraan 38 CrI3 + H2O2 + OH → CrO42 + IO4 + H2O (Basa) YouTube
Unsur-unsur bahkan dalam bentuk molekul ini kerap kali mempunyai bilangan oksidasi nol. Pada reaksi diatas hidrogen teroksidasi dari bilangan oksidasi 0 menjadi +1, sementara itu fluorin tereduksi dari bilangan oksidasi 0 menjadi -1. Saat reaksi oksidasi dan reduksi digabungkan elektron yang terlibat akan saling mengurangi:
Setarakan Reaksi Berikut Dengan Metode Bilangan Oksidasi Cr O My XXX Hot Girl
Oksidasi 1 mol Cr2+ menjadi CrO4²- melepaskan elektron sebanyak.. - 12228527. baniot baniot 15.09.2017 Kimia Sekolah Menengah Atas terjawab • terverifikasi oleh ahli Oksidasi 1 mol Cr2+ menjadi CrO4²- melepaskan elektron sebanyak.. 1 Lihat jawaban itu kak yang Cr2+ jadi CrO4²- itu melepas brp elektron
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi My XXX Hot Girl
A. 0,3 mol D. 2 mol B. 0,5 mol E. 3 mol C. 1 mol 3. Oksidasi 1 mol Cr2- menjadi CrO4 2- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol C. 3 mol 4. Pada reaksi KMnO4 + H2 SO4 + H2 C2 O4 K2 SO4 + MnSO4 + CO2 + H2 O. Dari 0,1 mol KMnO4 akan menghasilkan gas CO2 pada STP sebanyak.
PPT REAKSI OKSIDASI REDUKSI PowerPoint Presentation, free download ID6935360
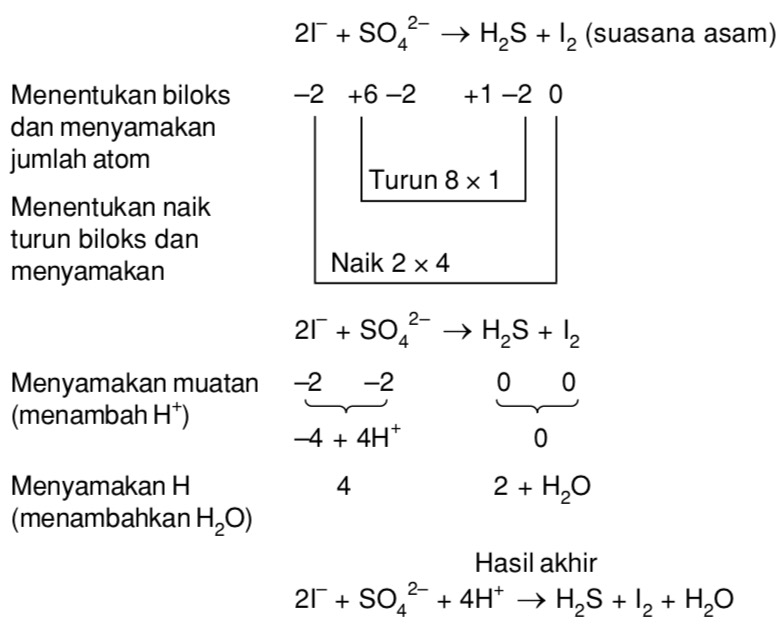
Reaksi reduksi dan oksidasi dapat melibatkan elektron, dengan melepaskan atau membutuhkan elektron. Untuk mengetahui jumlah elektron yang terlibat pada reaksi KI → KIO 3 maka dapat dengan menentukan setengah reaksi oksidasinya. Pada reaksi tersebut yang terlibat dengan reaksi oksidasi adalah unsur I .
Setarakan Reaksi Redoks Berikut Dengan Metode Bilangan Oksidasi
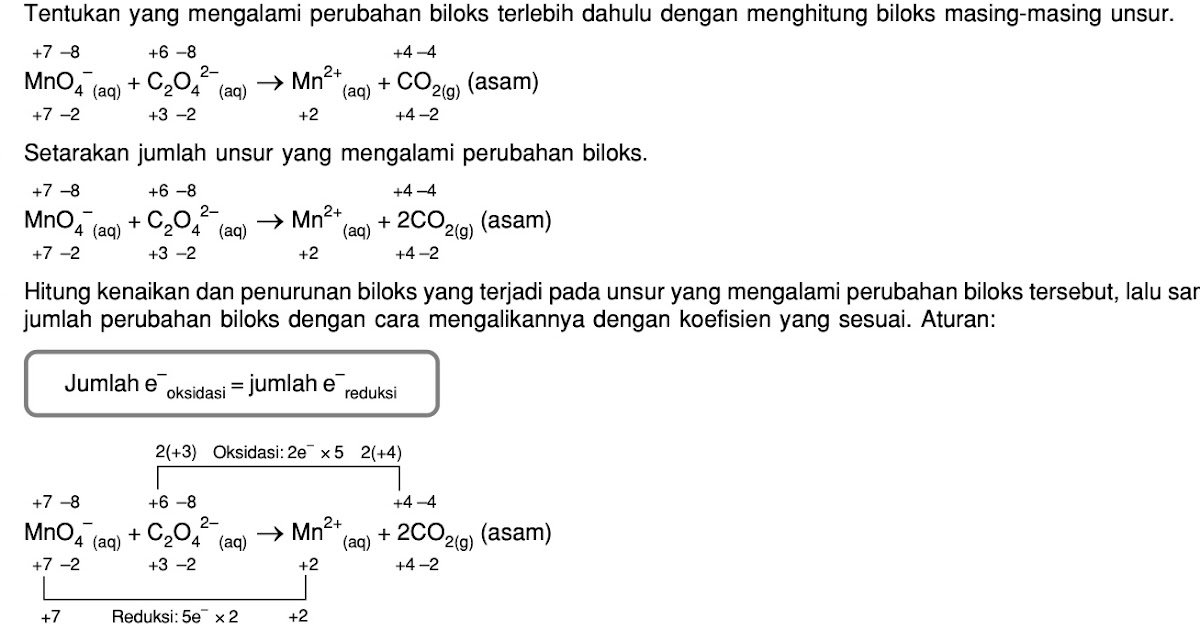
Jawaban: Oksidasi 1 mol Cr3+ menjadi CrO4^2- melepaskan elektron sebanyak 3 elektron Berdasarkan konsep perubahan bilangan oksidasi, reaksi reduksi adalah reaksi yang mengalami penurunan bilangan oksidasi. Sedangkan reaksi oksidasi adalah reaksi yang mengalami kenaikan bilangan oksidasi. Reaksi oksidasi yang belum setara adalah: Cr3+ → CrO4^2.

Metode PBO, Penyetaraan 9 CrO42 + Fe(OH)2 → Cr2O3 + Fe(OH)3 (suasana basa) YouTube
Oksidasi 1 mol Cr³ menjadi CRO4- melepaskan selektif sebanyak. SD. Oksidasi 1 mol Cr³ menjadi CRO4- melepaskan selektif sebanyak. 9. 0.. Tulislah nama yang benar untuk senyawa di bawah ini menggunakan Sistem Yunani dan Bilangan Oksidasi! (j)PCI5. 17. 0.0. Jawaban terverifikasi.

Reaksi Reduksi Oksidasi dalam Kimia Organik (Kimia SBMPTN, UN, SMA) YouTube
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol. Oks : 3e- Artinya : 1 mol Cr3+ akan melepas 3 mol elektron. @2020, Direktorat SMA, Direktorat Jenderal PAUD, DIKDAS dan DIKMEN 14. Mn2+ diperlukan larutan KMnO4 0,1 M sebanyak.. A. 200 ml D. 20 ml B. 100 ml E. 10 ml

Soal Kimia Reaksi Oksidasi Reduksi Kelas X Sma
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol D. 4 mol B. 2 mol E. 5 mol C. 3 mol 4. Diberikan persamaan reaksi (belum setara) : IO3- (aq) + I- (aq) + H+ (aq) → I2 (aq) + H2O (l) Perbandingan mol I- terhadap I2 pada reaksi setara adalah..

PENYETARAAN REAKSI REDOKS DENGAN METODE BILANGAN OKSIDASI YouTube
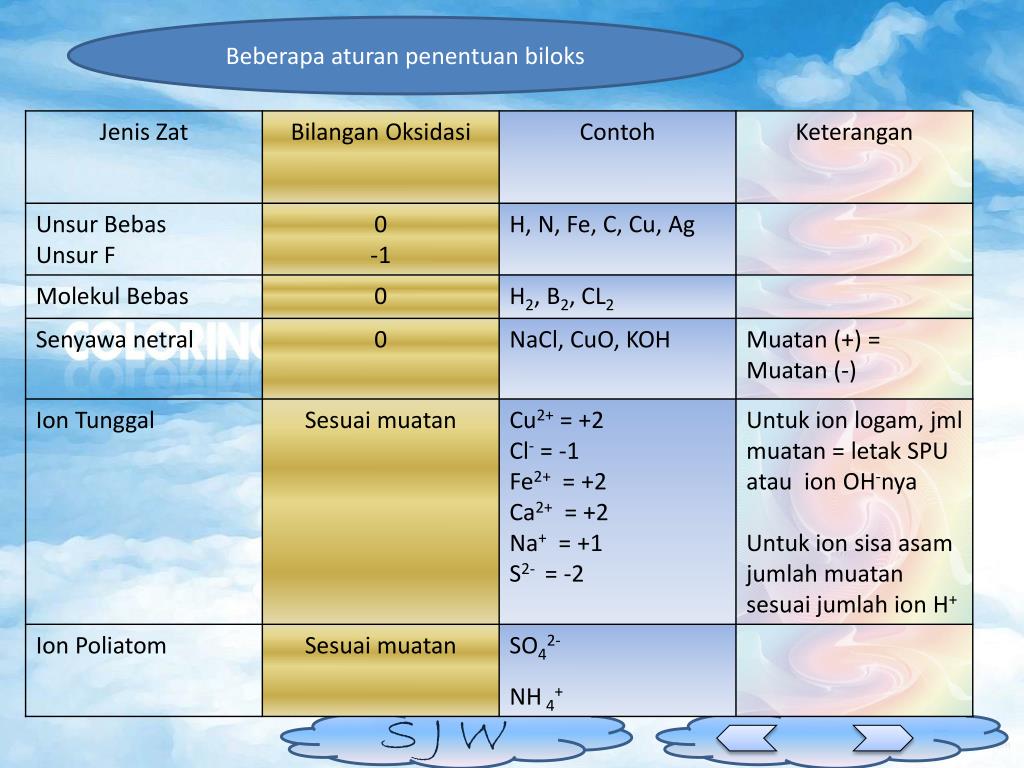
Ada 8 aturan dalam menentukan bilangan oksidasi suatu unsur, di antaranya: 1. Bilangan oksidasi unsur bebas adalah 0. Unsur bebas adalah unsur yang tidak bergabung atau berikatan secara kimia dengan unsur lain. Unsur bebas terbagi menjadi dua, yaitu unsur bebas berbentuk atom, seperti C, Ca, Cu, Na, Fe, Al, Ne dan unsur bebas berbentuk molekul.

Contoh Soal Bilangan Oksidasi Dan Jawabannya Contoh Soal Terbaru
Oksidasi 1 mol Cr3+ menjadi CrO42- melepaskan elektron sebanyak.. A. 1 mol . B. 2 mol . C. 3. Jumlah H+ dan elektron terlibat yang tepat untuk setengah reaksi oksidasi Cr3+ menjadi CrO42- pada suasana asam adalah.. A. 4H+ dan 3e-. Untuk mengoksidasi 2 mol ion C2O42- diperlukan ion MnO4- sebanyak.. A. 0,3 mol . B. 0,5 mol . C.